Allelopatia
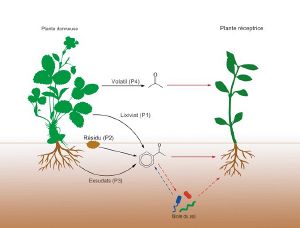
Allelopatia to zbiór interakcji biochemicznych zachodzących między roślinami lub między roślinami a mikroorganizmami.
Definicja
Pochodzenie słowa wywodzi się z greckiego allelo („wzajemnie”) oraz pathos („cierpienie”, „dotknięcie”). Ta etymologia sugeruje, że te interakcje są negatywne: konkurencja o zasoby, mechanizmy obronne. Obecne znaczenie allelopatii obejmuje również interakcje pozytywne, takie jak zjawiska współpracy lub stymulacji mikroorganizmów. Interakcje te zachodzą za pośrednictwem związków zwanych substancjami allelochimicznymi, uwalnianych przez roślinę do jej środowiska. Najczęściej są to metabolity wtórne należące do bardzo różnych rodzin biochemicznych[1].
Zasady
Związki chemiczne biorące udział w allelopatii mogą być uwalniane przez roślinę trzema drogami:
- korzenie (egzudacja)
- części nadziemne (wymywanie lub lotność)
- rozkład resztek martwej rośliny

Allelopatia jest głównie znana ze swojego znaczenia w kontroli zachwaszczenia pól (efekt hamujący wzrost chwastów). Stosuje się ją w zmianowaniu upraw, zarówno w międzyplonie z okrywy roślinne jak i w uprawie z mulczem, a nawet poprzez bioherbicides. W perspektywie agroekologicznego prowadzenia upraw allelopatia jest szczególnie interesująca, ponieważ pozwala ograniczyć zabiegi odchwaszczanie, a czasem odgrywa rolę w zwalczaniu szkodniki i patogenów roślinnych (praktyka biofumigation).
Substancje allelochimiczne
Według typów
Substancje allelochimiczne prowadzą do interakcji między osobnikami różnych gatunków, są to substancje międzygatunkowe. Wyróżnia się allomony, kairomony i synomony[3].
- Allomony : Allomon to substancja produkowana przez organizm żywy, która oddziałuje na inny organizm innego gatunku, na korzyść gatunku emitującego.
- Kairomony : To substancja produkowana przez organizm żywy, która oddziałuje na inny organizm innego gatunku, na korzyść gatunku odbierającego.
- Synomony : Synomon to substancja produkowana przez organizm żywy, która oddziałuje na inny organizm innego gatunku, na wzajemną korzyść gatunku emitującego i odbierającego.
Według rodzin chemicznych
Molekuły allelochimiczne to głównie:
- kwasy fenolowe, które mogą zaburzać absorpcję mineralne przez roślinę
- chinony, które mogą wpływać na ekspresję genów u organizmów docelowych
- terpeny, znane z hamowania wzrostu niektórych roślin poprzez inaktywację enzymów wzrostu.
Przykłady roślin allelopatycznych
orzech (Juglans nigra): uwalnia substancję zwaną juglonem, głównie z korzeni, która hamuje wzrost wielu innych roślin, szczególnie upraw pomidorów, ziemniaków i niektórych warzyw.
Eukaliptus (rodzaj Eucalyptus): jego liście zawierają olejki eteryczne allelopatyczne, które podczas rozkładu mogą ograniczać kiełkowanie roślin sąsiednich.
Ryż: niektóre odmiany ryżu produkują substancje allelochimiczne, które mogą hamować wzrost chwastów w polach ryżowych.
Czosnek (Allium sativum): uwalnia związki allelochimiczne, które mogą hamować niektóre niepożądane chwasty i ograniczać choroby w glebie.
Zastosowania w rolnictwie
Biofumigation i glukozynolany
Glukozynolany to wtórne metabolity węglowodanowe zawierające siarkę, produkowane głównie przez rośliny z rzędu Capparales, do których należą kapustowate (Brassicacea)[4].

Kapustowate znane z biofumigacji[5]
- Brunatna gorczyca (Brassica juncea): wydaje się mieć najsilniejsze działanie allelopatyczne. Zawiera wysokie stężenia aktywnych glukozynolanów, produkujących lotne izotiocyjaniany (ITC) o szybkim działaniu z części nadziemnych i korzeni. Testy in vitro wykazały zdolność resztek brunatnej gorczycy do hamowania wzrostu grzybni Aphanomyces euteiches, patogena grochu.
→ Zobacz kartę techniczną Wprowadzanie międzyplonów o działaniu allelopatycznym dla szczegółów dotyczących brunatnej gorczycy i jej zastosowania w polu.
- Rzepak (Brassica napus): często wymieniany ze względu na swoje właściwości „oczyszczające” dzięki glukozynolanom obecnym w nasionach i częściach wegetatywnych. Jego resztki mogą przyczyniać się do biofumigacji poprzez uwalnianie ITC o szybkim i wolnym działaniu, odpowiednio z części nadziemnych i korzeni. Jednak w dojrzałości części wegetatywne rzepaku zawierają bardzo niskie stężenia aktywnych glukozynolanów.
- Biała gorczyca (Sinapis alba): zawiera niższe całkowite stężenia glukozynolanów niż rzepak i brunatna gorczyca, co daje jej mniejszy potencjał allelopatyczny. Produkuje mniej lotne ITC niż rzepak, co sugeruje wolniejsze działanie. Resztki białej gorczycy mogą spowalniać wzrost grzybni Aphanomyces euteiches.
- Czarna gorczyca (Brassica nigra): to potencjalnie obiecująca kapustowata pod kątem działania na pędzik pszenicy, ze względu na skład glukozynolanów.
Allelopatia chwastów na rośliny uprawne
- Dzikie owies (Avena fatua) znacząco ogranicza wzrost liści i korzeni pszenicy dzięki egzudatom korzeniowym.
- Owies szorstki (Avena strigosa) wykazał efekt hamujący wzrost różnych chwastów, w tym redukcję biomasy i pokrycia.
Allelopatia roślin uprawnych na chwasty
- Słonecznik (Helianthus annuus) ma silny potencjał allelopatyczny na wiele chwastów, wpływając na kiełkowanie i wzrost białej gorczycy (Leather, 1983)[6].
- Rzepik pospolity (Artemisia annua) produkuje artemizyninę, związek o udowodnionych właściwościach fitotoksycznych, który hamuje wzrost chwastów zarówno w laboratorium, jak i w polu[7].
Allelopatia roślin uprawnych na inne rośliny uprawne
Może wynikać z efektów resztek uprawnych na powierzchni lub w glebie, zmianowania, praktyk uprawowych itd.
lucerna (Medicago saliva L.) jest autotoksyczna i allelopatyczna, wysokość i świeża masa lucerny są mniejsze na glebie po polu lucerny niż na glebie po polu sorgo. Związki allelochimiczne w glebie pod lucerną są zaangażowane w hamowanie wzrostu.
Wodne ekstrakty rozkładających się resztek ryżu (Oryza sativa) hamują wzrost korzonka sałata.
Efekty owadobójcze
Devakumar i Parmar (1993) odkryli, że ponad 300 roślin jest zdolnych do ograniczenia liczby wielu owadów. W Maroku Fahad i in. (2012) przeprowadzili badanie nad efektem owadobójczym egzudatów korzeniowych Mandragora autumnalis Bertol (mandragora) na Ceratitis capitata. Wysokie stężenia wodnych i etanolowych ekstraktów korzeni mandragory (30g/20ml i 20g/ml) powodują zaburzenia w układzie trawiennym, objawiające się obrzękiem odwłoka i blokadą wydalania, co prowadzi do śmierci Ceratitis capitata[8].

Efekty nicieniobójcze
Kapustowate (Brassicacea) są znane z działania nicieniobójczego podczas rozkładu. Rozkład uwalnia biobójcze izotiocyjaniany, które pod wpływem enzymu mirozynazy wpływają na pasożytnicze nicienie.
Ograniczenia
Chociaż allelopatia ma obiecujący potencjał w zarządzaniu uprawami, jej zastosowanie na dużą skalę w rolnictwie napotyka na kilka ograniczeń.
- W warunkach rzeczywistych jest niezwykle trudno oddzielić efekty allelopatyczne od efektów konkurencji o zasoby[6]. Oba zjawiska współdziałają i wpływają na wzrost roślin, co utrudnia izolację specyficznego wpływu allelopatii.
- Różnorodność molekuł allelochimicznych produkowanych, poziomy ich stężeń w zależności od gatunków i odmian oraz wrażliwość patogeny na te molekuły utrudniają przewidywanie i uogólnianie efektów allelopatycznych[5].
- czynniki środowiskowe takie jak klimat, typ gleby i praktyki uprawowe silnie wpływają na ekspresję allelopatii. Na przykład tekstura gleby, pH, materia organiczna i poziomy azot mogą wpływać na retencję i rozkład związków allelochimicznych.
- Allelopatia nie ogranicza się do interakcji roślina-roślina, obejmuje także mikroorganizmy glebowe. Związki allelochimiczne mogą wpływać nie tylko na docelowe patogeny, ale także na korzystne mikroorganizmy, co może mieć nieprzewidziane konsekwencje dla zdrowia gleby[6]. Konieczne jest ocenienie ogólnego wpływu praktyk allelopatycznych na ekosystem gleby. Potrzebne są dalsze badania w celu identyfikacji specyficznych związków allelochimicznych, ich mechanizmów działania, trwałości w glebie oraz wpływu na różne organizmy glebowe.
- ↑ C Aubertin, 2018, https://dicoagroecologie.fr/dictionnaire/allelopathie/
- ↑ Gfeller et Wirth, (2017)
- ↑ Académie de Montpellier [page consultée le 25/10/2024] https://tice.ac-montpellier.fr/ABCDORGA/Famille6/PHEROMONES.htm
- ↑ Potentiels de régulation biotique par allélopathie et biofumigation et dis-services produits par les cultures intermédiaires multiservices de crucifères, L Alletto et al., 2018, https://draaf.nouvelle-aquitaine.agriculture.gouv.fr/IMG/pdf/3rdf2018-actes-1_cle415433.pdf
- ↑ 5,0 5,1 Un autre regard sur les successions de culture : Comprendre et utiliser l’allélopathie pour améliorer la gestion des cultures dans la rotation, R Reau et al., 2019, https://agroparistech.hal.science/hal-02314710/document
- ↑ 6,0 6,1 6,2 Effets allélopathiques d'une couverture d'avoine et leurs impacts sur la macrofaune du sol, Marie-Emilie EVENO, 2000, https://agritrop.cirad.fr/476940/1/ID476940.pdf
- ↑ L’allélopathie: un phénomène controversé, mais prometteur, J. WIRTH et al., Agroscope, 2012
- ↑ L’allélopathie : utilisation en agriculture biologique et son impact sur l’environnement, K El assri et al., 2021, https://www.researchgate.net/profile/Hassnae-Azoughar-2/publication/372079580_L'allelopathie_utilisation_en_agriculture_biologique_et_son_impact_sur_l'environnement/links/64a3ffa58de7ed28ba744ff4/Lallelopathie-utilisation-en-agriculture-biologique-et-son-impact-sur-lenvironnement.pdf